حمض الهيبوكبريتوز
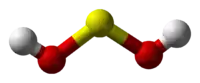
حمض الهيبوكبريتوز (أو حمض السلفوكسيليك) هو حمض أكسجيني لعنصر الكبريت صيغته H2SO2، ولكنه غير مستقر، وتوجد منه أملاح تسمى هيبوكبريتيت (أو سلفوكسيلات)، وهي أكثر استقراراً من الحمض نفسه.
| حمض الهيبوكبريتوز | |
|---|---|
 حمض الهيبوكبريتوز | |
| المعرفات | |
| CAS | 20196-46-7 |
| بوب كيم | 5460696 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | H2SO2 |
| الكتلة المولية | 66.07 غ/مول |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
يكون الكبريت في هذا المركب في حالة أكسدة مقدارها +2، ويمكن أن يعتبر حمض الهيبوكبريتوز كيميائياً على شكل ثنائي هيدروكسي الكبريت S(OH)2.[3][4]
التحضير
لا يمكن عزل هذا المركب بالشروط القياسية، وهو يتشكل مركباً وسطياً أثناء حلمهة مركبات الكبريت ثنائية الهالوجين، مثل ثنائي كلوريد الكبريت. يعتقد وجود هذا المركب في القرص النجمي الدوار.[5]
الخواص
توجد متصاوغات عدة من حمض الهيبوكبريتوز، منها حمض السلفينيك (HS(O)OH)، وكذلك هيدروبيروكسيد السلفهيدريل (HSOOH),[5]، وبيرسلفوكسيد ثنائي الهيدروجين H2SOO؛ إلا أن جميع هذه المركبات غير مستقرة أيضاً، ويعد حمض الهيبوكبريتوز أقل هذه المتصاوغات طاقةً.[6]
يتفكك حمض الهيبوكبريتوز إلى الكبريت وإلى أيونات البيكبريتيت 3−HSO، ومنها نتيجة الأكسدة بأكسجين الهواء،[7] إلى ثيوكبريتات 3−S2O2.
الأملاح
يمكن الحصول على أملاح الهيبوكبريتيت (السلفوكسيلات) من تفكك مركب ثنائي أكسيد الثيويوريا (CH4N2O2S) في المحاليل القلوية.[8][9] يعطي تفاعل أملاح الهيبوكبريتيت مع الفورمالدهيد ناتجاً يسمى الرونغاليت، وهو ذو تطبيقات مهمة في صناعة الأصبغة.[8]
من الأملاح المعروفة لهذا الحمض مركب سلفلوكسيلات الكوبالت CoSO2·3H2O.[7]
طالع أيضاً
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/5460696 — تاريخ الاطلاع: 6 أكتوبر 2016 — العنوان : sulfoxylic acid — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/5460696
- Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry (باللغة الإنجليزية). Academic Press. ISBN 9780123526519. مؤرشف من الأصل في 25 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Koritsanszky, Tibor; Juergen Buschmann; Peter Luger; Heinar Schmidt; Ralf Steudel (1994). "Sulfur compounds. Part 173. Structure and Electron Density of Solid Dimethoxydisulfane, (CH3O)2S2". The Journal of Physical Chemistry. 98 (21): 5416–5421. doi:10.1021/j100072a005. ISSN 0022-3654. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Crabtree, Kyle N.; Martinez, Oscar Jr.; Barreau, Lou; McCarthy, Michael C.; Thorwirth, Sven (2013). "Detection of the rotational spectrum of sulfoxylic acid (HOSOH)". hdl:1811/55161. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة) - Napolion, Brian; Huang, Ming-Ju; Watts, John D. (May 2008). "Coupled-Cluster Study of Isomers of H2SO2". The Journal of Physical Chemistry A. 112 (17): 4158–4164. Bibcode:2008JPCA..112.4158N. doi:10.1021/jp8009047. PMID 18399676. الوسيط
|CitationClass=تم تجاهله (مساعدة) - van der Heijde, Herman B. (2 September 2010). "Tracer studies in sulfoxylic acid chemistry: (Short communication)". Recueil des Travaux Chimiques des Pays-Bas. 73 (3): 193–196. doi:10.1002/recl.19540730304. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Makarov, S. V.; Salnikov, D. S.; Pogorelova, A. S. (9 March 2010). "Acid-base properties and stability of sulfoxylic acid in aqueous solutions". Russian Journal of Inorganic Chemistry. 55 (2): 301–304. doi:10.1134/S0036023610020269. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Grady, B.J.; Dittmer, D.C. (November 1990). "Reaction of perfluoroaryl halides with reduced species of sulfur dioxide (HSO2−, SO22−, S2O42−)". Journal of Fluorine Chemistry. 50 (2): 151–172. doi:10.1016/S0022-1139(00)80493-5. الوسيط
|CitationClass=تم تجاهله (مساعدة)
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
- بوابة الكيمياء